مقدمه
حافظه سلولی به قابلیت سلولها برای حفظ اطلاعات مربوط به تجربیات و محرکهای پیشین اشاره دارد، که تأثیر مستقیمی بر عملکردها و تواناییهای سازگاری آنها میگذارد. این حافظه از طریق مکانیسمهای زیستی مختلفی مثل تغییرات اپیژنتیکی و سازگاریهای مکانیکی شکل میگیرد.

مکانیسمهای حافظه سلولی

1. مکانیسمهای اپیژنتیکی
تغییرات اپیژنتیکی با ایجاد تغییر در بیان ژنها بدون دستکاری توالی DNA، نقش حیاتی در حافظه سلولی ایفا میکنند. این تغییرات شامل فرآیندهایی مانند متیلاسیون DNA و تغییرات هیستونی است که میتوانند به بیان پایدار ژنها در طول زمان منجر شوند. برای مثال، آرایش گروههای متیل روی دیانای، بهویژه در مناطق Enhancer، تعیین میکند که کدام ژنها در پاسخ به نشانههای محیطی فعال یا خاموش شوند. این تغییرات اپیژنتیکی غالباً قابل بازگشت هستند و پنجرهای درمانی برای مقابله با اختلالات سلولی، بهویژه در بیماریهایی مانند آلزایمر، فراهم میکنند؛ جایی که الگوهای استیله شدن هیستون و متیلاسیون DNA با افزایش سن و پیشرفت بیماری تغییر مییابند.
ساختار پویای کروماتین برای حفظ حافظه اپیژنتیکی ضروری است. مطالعات نشان دادهاند که نشانههای مکانیکی از محیط میتوانند باعث تغییر در سازمان کروماتین شوند، که این به نوبه خود بر بیان ژن و سرنوشت سلولی تأثیر میگذارد. این یافتهها حاکی از همکاری مکانیسمهای مکانیکی و اپیژنتیکی در حفظ حافظه سلولی است.
2. حافظه مکانیکی
حافظه مکانیکی به توانایی سلولها برای بهخاطر سپردن محرکهای مکانیکی پیشین اشاره دارد که بر رفتار و هویت آینده آنها تأثیر میگذارد. تغییرات در محیط مکانیکی میتواند منجر به پاسخهای پایدار شود، حتی پس از حذف محرک اولیه؛ پدیدهای که توسط تغییرات در ساختار کروماتین پشتیبانی میشود. بهعنوان مثال، سلولهای قلبی که در معرض بارهای مکانیکی خاص قرار میگیرند، میتوانند تغییر در «مکانیواستاز» خود را نشان دهند و در نتیجه بر انعطافپذیری و وضعیت عملکردی آنها تأثیر بگذارد.
مولکولهایی مانند میکروRNAها و آنزیمهای تغییردهنده هیستون در ذخیره این حافظه مکانیکی نقش دارند، که مدت زمان قرارگیری در معرض محرکهای مکانیکی تعیین میکند آیا پاسخ برگشتپذیر خواهد بود یا خیر. پژوهشهای اخیر نشان میدهند که حافظه مکانیکی ممکن است برای هموستاز در سطح اندام حیاتی باشد، که نشان میدهد سابقهی مکانیکی انباشتهی سلولها میتواند بر سلامت و تابآوری کلی بافت تأثیر بگذارد.
تلفیق مکانیسمها
تعامل بین تغییرات اپیژنتیکی و حافظه مکانیکی، شبکه پیچیدهای از مکانیسمهای حافظه سلولی را نشان میدهد. برای مثال، پیشتحریک مکانیکی بلندمدت میتواند انعطافپذیری اپیژنتیکی را تنظیم کند و به طور مؤثر حالتهای حافظه خاصی را تثبیت نماید که میتوانند بر رفتار سلول تأثیر بگذارند. درک این مکانیسمها نه تنها فرآیندهای زیستی بنیادی را روشن میسازد، بلکه پتانسیل بالایی برای راهبردهای درمانی در بیماریهایی دارد که با پاسخهای سلولی ناسازگار و اختلالات حافظه مشخص میشوند.
نقش حافظه سلولی در عملکردهای سلولی
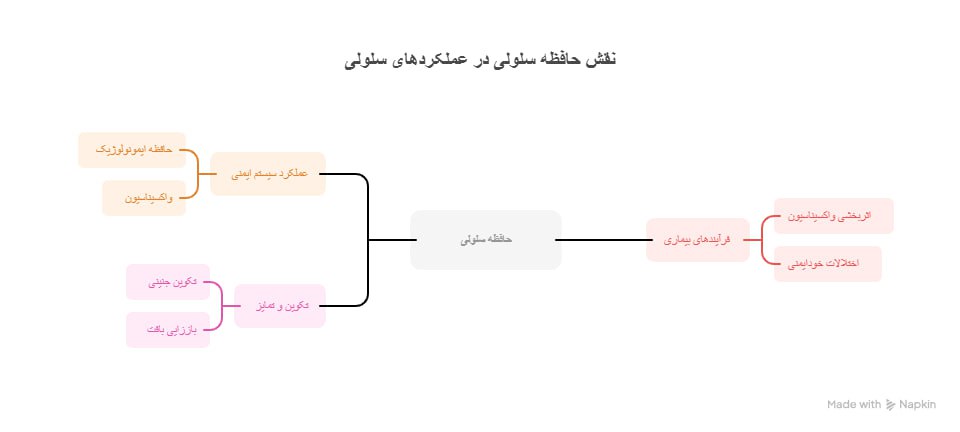
حافظه سلولی نقش حیاتی در عملکردهای متنوع سلولی ایفا میکند و به سلولها امکان میدهد هویت خود را حفظ کرده و به تغییرات محیطی به طور مناسب پاسخ دهند.
-
پیامدها در عملکرد سیستم ایمنی
یکی از جنبههای حافظه سلولی، حافظه ایمونولوژیک است که به سیستم ایمنی امکان میدهد عوامل بیماریزای قبلاً مواجهشده را با کارایی بیشتری شناسایی و پاسخ دهد. در اولین مواجهه با یک عامل بیماریزا، سلولهای ایمنی خاصی حافظهای ایجاد میکنند که پاسخ سریعتر و قویتری در مواجهه مجدد ممکن میسازد. این مکانیسم برای اثربخشی واکسیناسیون حیاتی است، چرا که واکسنها سیستم ایمنی اکتسابی را تحریک میکنند تا ایمنی بلندمدت در برابر عوامل بیماریزای خاص ایجاد کند.
-
تأثیر بر فرآیندهای بیماری
درک حافظه سلولی برای شناخت فرآیندهای مختلف بیماری ضروری است. برای مثال، تداوم و انعطافپذیری حافظه سلولی میتواند بر اثربخشی واکسیناسیون تأثیر بگذارد، چرا که ایمنی محافظتی ممکن است با گذشت زمان کاهش یابد و بر پیامدهای سلامت بلندمدت اثر بگذارد. به علاوه، بینظمی در حافظه سلولی میتواند به بروز بیماریهایی مانند اختلالات خودایمنی منجر شود، که در آن سیستم ایمنی به طور اشتباه به سلولهای خود بدن حمله میکند. این مسئله احتمالاً به دلیل ناتوانی سلولهای T حافظه در تشخیص صحیح آنتیژنهای خودی از غیرخودی رخ میدهد.
-
حافظه سلولی در تکوین و تمایز
در طول فرآیند تکوین، سلولها حافظهای از سلسله مراتب و شرایطی که تجربه کردهاند را حفظ میکنند که این بر تمایز آنها به انواع تخصصی سلولی تأثیر میگذارد. این مسئله بهویژه در فرآیندهایی مانند تکوین جنینی و باززایی بافت حائز اهمیت است، جایی که حافظهی حالتهای پیشین میتواند ویژگیهای عملکردی بافتهای بالغ را تعیین کند.
نقش حافظه سلولی در بیماریها
حافظه سلولی نقش حیاتی در بروز انواع بیماریها به ویژه سرطان و عفونتهای مزمن ایفا میکند. درک مکانیسمهای حافظه سلولی میتواند بینش ارزشمندی در مورد فرآیندهای بیماری، مداخلات درمانی و پاسخهای ایمنی ارائه دهد.
1- سرطان
سرطان اغلب بهعنوان یک بیماری ژنتیکی توصیف میشود که با تجمع جهشها در اونکوژنها و ژنهای سرکوبگر تومور مشخص میشود. این فرآیند به تکثیر کنترلنشده سلولی و تومورزایی منجر میگردد. در ریزمحیط تومور، پاسخهای ایمنی ممکن است دچار اختلال شوند که این امر بر اثربخشی حافظه سلولی تأثیر میگذارد. تومورهای “داغ” مانند ملانوما و سرطان ریه سلول غیرکوچک (NSCLC)، دارای بار جهشی بالا و ناپایداری قابل توجه DNA هستند که منجر به تولید مجموعه متنوعی از نئوآنتیژنهای جهشیافته میشود. این شرایط، ورود سلولهای T نفوذکننده به تومور را که قادر به تشخیص این نئوآنتیژنها هستند، تسهیل میکند. سیستم ایمنی میتواند با تولید مداوم امواجی از کلونهای سلول T ویژهآنتیژنهای جهشیافته، با جهشهای مداوم تومور مقابله کند که این موضوع، قدرت سلولهای حافظه در کنترل پیشرفت تومور را برجسته میسازد. با این حال، شکلگیری حافظه ایمنی بلندمدت در زمینه سرطان، به دلیل اختلال در عملکرد و فرسودگی سلولهای T با چالش مواجه است؛ بهویژه در محیطهای عفونت مزمن.
مکانیسمهای مهارکننده فعالیت سلولهای T، از جمله فعالشدن سلولهای T تنظیمی، میتوانند ایجاد پاسخهای حافظه مؤثر را مختل کنند و در نتیجه به رشد و تداوم تومور منجر شوند. علاوه بر این، تعامل بین سیستم عصبی و ریزمحیط تومور میتواند بر پیشرفت سرطان تأثیر بگذارد، چرا که پاسخهای استرس ممکن است رشد تومور را تشدید کرده و پاسخ ایمنی را تحتتأثیر قرار دهند.
2- عفونتهای مزمن
در عفونتهای مزمن، حافظه ایمونولوژیک برای کنترل اثرات عوامل بیماریزا حیاتی است. سلولهای T حافظه برای شناسایی و پاسخ سریعتر به عوامل بیماریزای قبلی ضروری هستند و این نقش در مدیریت عفونتهای ویروسی مزمن از اهمیت بالایی برخوردار است. با این حال، مواجهه مزمن با آنتیژنها میتواند به فرسودگی سلولهای T منجر شود، حالتی که با کاهش عملکرد و اختلال در تشکیل حافظه ایمنی مشخص میشود. این پدیده مدیریت عفونتهای مزمن را پیچیده میکند، زیرا سلولهای حافظه ممکن است در ایجاد یک پاسخ قوی به عفونت مجدد یا فعالسازی مجدد ویروسهای نهفته ناتوان باشند.
3- بیماریهای خودایمنی
مفهوم حافظه سلولی به بیماریهای خودایمنی نیز گسترش مییابد، جایی که سیستم ایمنی به اشتباه به آنتیژنهای خودی حمله میکند. در این شرایط، هدف از ایجاد یک پاسخ ایمنی تهاجمی به بازیابی تحمل به آنتیژنهای خودی پایدار تغییر میکند. مکانیسمهای مربوط به تنظیم سلولهای حافظه، مانند تقویت سلولهای T تنظیمی یا استفاده از آگونیستهای نقاط بازدارنده سلولهای T، در حال بررسی هستند تا پاسخهای خودایمنی کاهش یافته و تعادل ایمنی حفظ شود.
راهبردهای درمانی
پیشرفتهای پژوهشهای حافظه سلولی، راه را برای رویکردهای درمانی نوآورانه باز میکنند. برای مثال، شناسایی مکانیسمهای مولکولی دخیل در حافظه سلولی مانند هیستون داستیلاز ۳ (HDAC3)، اهداف درمانی بالقوهای ارائه میدهد که میتوانند انعطافپذیری شناختی و حفظ حافظه را بهویژه در جمعیتهای مسن بهبود بخشند. این تمرکز بر مسیرهای مولکولی نهتنها به درک چگونگی ذخیرهسازی حافظه کمک میکند، بلکه راهبردهای درمان اختلالات مرتبط با حافظه را نیز شکل میدهد.
علاوهبر این، کاربرد فناوری ویرایش ژن CRISPR-Cas9 بهعنوان یک دستاورد بزرگ در مقابله با بیماریهای خودایمنی ظهور کردهاست. این روش امکان ایجاد تغییرات دقیق در بیان ژن را فراهم میکند که با هدف قراردادن علل ریشهای این بیماریها میتواند به بهبود نتایج درمانی منجر شود. برای مثال، مطالعات اخیر با استفاده از فناوری کریسپر، نتایج امیدبخشی در تولید سلولهای CAR-T ایمنتر برای درمان بیماریهای خودایمنی مقاوم به درمان نشان دادهاند. که این امر پتانسیل کریسپر برای ایجاد انقلابی در رویکردهای درمانی در حوزههای مختلف پزشکی را برجسته میسازد.
برای آشنایی بیشتر با روشهای ویرایش ژن و ژندرمانی، اینجا کلیک کنید.
چالشها و جهتگیریهای آینده
علیرغم این پیشرفتها، چالشهای قابل توجهی در این حوزه وجود دارد. برای مثال، راهبردهای درمانی که شامل تنظیم سیگنالدهی عصبی هستند، باید تعادل بین تسکین علائم بیماری و حفظ عملکردهای طبیعی عصبی برقرار کنند. اختلال در این فرآیندها میتواند به پیامدهای عصبی نامطلوبی مانند ناهنجاریهای حسی محیطی منجر شود. از این رو، پژوهشهای آینده باید با هدف توسعه روشهای دقیقتر برای تنظیم انتخابی فعالیت عصبی، همزمان با حفظ عملکردهای سالم عصبی طراحی شوند. افزون بر این، درک عمیقتر از برهمکنشها و مسیرهای مولکولی دخیل در حافظه سلولی برای پیشبرد راهبردهای درمانی ضروری خواهد بود.
همچنان که محققان به کشف پیچیدگیهای حافظه سلولی و نقش آن در بیماری ادامه میدهند، این پتانسیل وجود دارد که مداخلات هدفمندی توسعه یابند که نهتنها به درمان بیماریها بپردازند، بلکه حتی قادر به معکوسکردن روند شرایط تخریبکننده عصبی و سایر بیماریهای مرتبط با اختلال حافظه سلولی باشند. ادغام فناوریهای پیشرفتهای مانند کریسپر و سایر روشهای ویرایش ژن در پژوهشهای درمانی، نقشی کلیدی و تحولی در درمان خواهد داشت.
منابع
- Epigenetic modifications in metabolic memory: What are the memories, and can we erase them?
- Mechanically induced alterations in chromatin architecture guide the balance between cell plasticity and mechanical memory
- T Cell Memory in Infection, Cancer, and Autoimmunity
- Study finds cell memory can be more like a dimmer dial than an on/off switch
-
Memory problems in old age linked to a key enzyme, study in mice finds
- Breaking barriers: advancing cellular therapies in autoimmune disease management
-
Cell-based regenerative and rejuvenation strategies for treating neurodegenerative diseases
نویسنده: روان فخرالدین