مقدمه
ژنتراپی روشی انقلابی است که ریشه در دهه ۱۹۷۰ دارد و شامل افزودن، حذف یا تغییر مواد ژنتیکی درون سلولهای بیمار برای درمان بیماریها میشود. طی دهههای اخیر، این روش از یک مفهوم نظری به درمانهای بالینی تأییدشده تکامل یافته و از حاملهای ویروسی و غیرویروسی برای رساندن اسیدهای نوکلئیک درمانی و تنظیم بیان ژن استفاده میکند.
دو دستهی اصلی در ژن تراپی وجود دارد
-
-
ژنتراپی سلولهای زایا (GGT)
-
سلولهای تولیدمثلی را تغییر میدهد (در حال حاضر به دلایل اخلاقی ممنوع است).
-
-
ژنتراپی سلولهای سوماتیک (SCGT)
-
بر سلولهای غیر سلولهای زایا تمرکز دارد و اصلیترین روش مورد مطالعه در پژوهشهای بالینی است.
راهبردهای ژن درمانی و سلول درمانی سوماتیک
-
In Vivoدرون تنی
تزریق مستقیم ناقلهای ژنی به بیمار.
-
Ex Vivo برون تنی
سلولهای بیمار استخراج شده، بهصورت خارجی اصلاح ژنتیکی میشوند و سپس دوباره به بدن بازگردانده میشوند.
ناقلهای رایج
شامل AAVها، لنتیویروسها (LVs)، رتروویروسها، آدنوویروسها و روشهای غیرویروسی مانند پلاسمیدها و نانوذرات میشود.
چشمانداز کارآزماییهای بالینی (تا سال ۲۰۲۳)
- بیشترین هدف در ژنتراپی، درمان سرطان ۶۸.۵٪ و پس از آن بیماریهای تکژنی ۱۲.۸٪ است.
- اکثر کارآزماییها در مراحل اولیه فاز I و I/II قرار دارند.
- ناقلهای ویروسی (حدود دوسوم مطالعات) بهویژه آدنوویروسها (AdVs)، لنتیویروسها (LVs) و AAVها غالب هستند.
چهار استراتژی اصلی ژن درمانی
- جایگزینی ژن (Gene replacement)
- خاموشسازی ژن (Gene silencing)
- افزودن ژن (Gene addition)
- ویرایش ژن (Gene editing)
انتقال ژن با چالشهای متعددی روبرو است از جمله: تعیین روش بهینه انتقال، ملاحظاتی مانند اندازه ژن، ایمونوژنیسیتی و اختصاصیت حامل، مسائل تولید مانند هزینه و فرآیند. همه این موارد نیازمند تحقیقات علمی دقیق هستند.

درک بهتر روشهای ژن درمانی
-
جایگزینی ژن
در جایگزینی ژن، یک کپی سالم از ژن منتقل میشود تا اثر جهشهای منجر به از دست رفتن عملکرد اصلی ژن را جبران کند. این روش، بهویژه برای اختلالات مغلوب تکژنی، بسیار مؤثر است و با استفاده از وکتورهایی مانند AAV، تولید پروتئین را بازیابی میکند. این رویکرد میتواند علائم بیماری را بهبود بخشد، حتی اگر تنها بخشی از سلولها ژن درمانی را بیان کنند. با این حال، این روش قادر به رفع جهشهای غالب یا ژنهای بسیار بزرگی که از ظرفیت وکتور فراتر میروند، نیست.
-
خاموشی ژن
هدف خاموشی ژن، کاهش یا توقف بیان ژنهای مضر با عملکرد افزایشی است. پلتفرمهای رایج شامل rAAV-mediated RNA interference (RNAi) و سیستمهای CRISPR–Cas13 است که mRNA را هدف قرار میدهند. کاربردهای چشمی این فناوری عمدتاً بر داروهای siRNA علیه فاکتورهایی مانند VEGF در بیماریهای شبکیه متمرکز است. از جمله چالشهای این روش میتوان به ناپایداری RNA، اثرات خارج از هدف و پیشرفت محدود در آزمایش بالینی اشاره کرد.
-
افزودن ژن
در روش افزودن ژن، ژنهای جدید یا کمکی به منظور تنظیم مسیرهای بیماری معرفی میشوند، بدون اینکه ژن جهشیافته مستقیماً اصلاح شود. از جمله مثالهای این روش میتوان به انتقال فاکتورهای نوروتروفیک برای بیماریهای تخریب عصبی یا کدکردن پادتنها از طریق rAAV به عنوان واکسن زنده علیه HIV اشاره کرد.
این استراتژی دامنه درمان را فراتر از نقصهای صرفاً ژنتیکی گسترش میدهد، اما با چالشهایی مانند پاسخهای ایمنی ناشی از وکتور و مشکلات هدفگیری بافتی روبرو است.
-
ویرایش ژن
ویرایش ژن با استفاده از نوکلئازهای قابل برنامهریزی یا ویرایشگرهای باز، تغییرات دقیقی در ژنوم ایجاد میکند. روشهای مورد استفاده شامل این روشها است:
- سیستمهای CRISPR–Cas مانند Cas9 و Cas12 برای ایجاد برشهای هدفمند در DNA که به وسیله مکانیسمهایNHEJ یا HDR ترمیم میشوند.
- ویرایشگرهای باز مانند ABE و CBE که قادرند بازهای منفرد را، بدون ایجاد شکست در دو رشتهی DNA ، تغییر دهند.
- ویرایشگرهای اولیه که ترکیبی از Cas9 ،ایجادکننده برش تک رشتهای، و ترانسکریپتاز معکوس هستند و امکان انجام اصلاحات متنوع از جمله اضافه حذف و تصحیح را فراهم میکنند.
این ابزارها از ویژگیهای منحصر به فردی مانند دقت بالا و توانایی اصلاح مستقیم جهشهای نقطهای برخوردارند، اما نیازمند کنترل دقیق فعالیت خارج از هدف و بهبود کارایی انتقال به سلولها هستند.
بیشتر در مورد روشهای ویرایش ژن بدانیم.
نوکلئازهای قابل برنامهریزی
نوکلئازهای قابل برنامهریزی با ایجاد شکستهای دو رشتهای هدفمند (DSBs) در نواحی خاص ژنومی، مکانیسم ترمیم سلولی را فعال میکنند. این فرآیند عمدتاً دو نتیجه دارد:
- اتصال انتهای غیرهمولوگ (NHEJ)
- معمولاً باعث ایجاد حذف یا اضافه شدن نوکلئوتیدها میشود که منجر به اختلال در عملکرد ژن میگردد.
- بیشتر برای خاموش کردن ژنهای بیماریزا استفاده میشود.
- ترمیم هدایتشونده با همولوگ (HDR)
- با استفاده از یک ماتریس اصلاحی (template)، ترمیم دقیق انجام میشود.
- برای اصلاح جهشها یا درج توالیهای درمانی ایدهآل است.
انواع نوکلئازهای قابل برنامهریزی
1. نوکلئازهای انگشت روی (ZFNs)
- از دامنههای اتصال DNA قابل طراحی بر پایه زینک فینگر متصل به اندونوکلئازFokI تشکیل شدهاند.
- برای ایجاد برش نیاز به دایمرشدن دارند.
- مزیت: طراحی نسبتاً مشخص برای توالیهای هدف.
- چالش: زمانبر بودن تولید و احتمال فعالیت خارج از هدف.
2. نوکلئازهای اثرگذار شبه فعالکننده رونویسی (TALENs)
- از تکرارهای ماژولار برای شناسایی تک بازهای DNA استفاده میکنند و با FokI جفت میشوند.
- مزیت: ویژگی هدفیابی بالا و انعطافپذیری بیشتر نسبت به ZFNs.
- چالش: اندازه بزرگتر و پیچیدگی در ساخت.
3. مگانوکلئازها
- اندونوکلئازهای طبیعی که توالیهای هدف طولانی ( ۱۴-۴۰جفت باز) را تشخیص میدهند.
- مزیت: اتصال بسیار اختصاصی.
سیستمهای CRISPR-Cas
سیستمCRISPR-Cas از یک RNA راهنما برای هدایت اندونوکلئاز Cas به ناحیه هدف DNA حاوی توالی PAM استفاده میکند. آنزیمهای دسته ۲، شامل Cas9، Cas12 و Cas13 هستند، که به صورت تکپروتئینی عمل کرده و به ترتیب DNA Cas9 Cas12 و RNA (Cas13) را با دقت بالا و قابلیت هدفگیری مجدد برش میدهند.
انواع اصلی سیستمهای CRISPR-Cas:
- Cas9نوع II ایجاد برشهای صاف دو رشتهای DNA (blunt DSBs)؛ پرکاربردترین سیستم.
- Cas12نوع V ایجاد برشهای پلکانی(staggered cuts) ؛ گستردهتر شدن طیف توالیهای PAM قابل شناسایی.
- Cas13 نوع VI هدفگیری RNA، امکان خاموشی موقت ژنها بدون ایجاد تغییر در DNA
این سیستمها انقلابی در مهندسی ژنتیک ایجاد کردهاند و برای درمان بیماریها، تحقیقات پایه، و بیوتکنولوژی کشاورزی استفاده میشوند.
ویرایش بازها (Base Editing)
ویرایشگرهای باز، یک باز DNA را به باز دیگر تبدیل میکنند بدون ایجاد شکست دو رشتهای DNA و وابستگی به مسیرهای ترمیم غیرقابل پیشبینی را کاهش میدهند. آنها با اتصال یک دآمیناز به یک Cas nickaseبا فعالیت کاتالیتیکی ضعیف، تغییرات دقیقی در نوکلئوتیدها ایجاد میکنند.
- ویرایشگرهای باز سیتوزینی (CBEs): تغییر C•G به T•A از طریق دآمیناسیون سیتیدین.
- ویرایشگرهای باز آدنینی (ABEs): تبدیل A•T به G•C از طریق دآمیناسیون آدنین.
ویرایش بازهای RNA
ویرایشگرهای RNA با اتصال یک Cas13 غیرفعال کاتالیتیکی به دآمینازها، ترانسکریپتها را به روشی برگشتپذیر و موقت اصلاح میکنند.
این سیستمها تبدیل A-to-I آدنین به اینوزین یا C-to-U سیتوزین به اوراسیل را در mRNA انجام میدهند که مزیت ایمنی بالقوهای نسبت به ویرایشهای دائمی DNA ارائه میدهد. پلتفرمهای RESCUE (C-to-U) و REPAIR (A-to-I) امکان ایجاد تغییرات برنامهریزی شده در RNA را فراهم میکنند.
کاربردها
- اصلاح موقت آللهای بیماریزا
- تنظیم فرآیندهای اسپلایسینگ یا ترجمه
ویرایش اولیه (Prime Editing)
ویرایشگرهای اولیه یک Cas9 nickase را با ترانسکریپتاز معکوس ترکیب میکنند که توسط یک RNA راهنمای ویرایش اولیه (pegRNA) هدایت میشود. این سیستم یک رشته DNA را میبرد، از الگوی pegRNA برای نوشتن توالیهای جدید استفاده میکند و هیچ DSB باقی نمیگذارد، که دامنه کار را برای تمام تغییرات باز، حذف و اضافههای کوچک و ترکیبات آنها گسترش میدهد.
- PE2: نسل اول با ترکیب nickase-RTو pegRNA
- PE3/PE3b: یک برش دوم اضافه میکند تا کارایی ویرایش را بهبود بخشد.
- PE4/PE5 و PEmas: مهارکنندههای ترمیم ناهمخوانی یا pegRNAهای مهندسی شده را، برای افزایش بازده و خلوص، ترکیب میکنند.
سیستمهای دارورسانی
حاملهای ویروسی به دلیل کارایی استثنایی خود، گزینه اصلی برای انتقال DNA محسوب میشوند. اگرچه ژنتراپی عمدتاً بر حاملهای ویروسی تکیه دارد، اما حاملهای غیرویروسی نیز به عنوان روشی مکمل برای غلبه بر برخی معایب حاملهای ویروسی مانند ایمونوژنیسیتی و محدودیتهای بستهبندی مطرح شدهاند.
تحویل ویروسی
حاملهای ویروسی،که شامل رتروویروسها، لنتیویروسها، آدنوویروسها و AAV به دلیل کارایی بالای ترانسداکشن و توانایی بیان بلندمدت بهطور گسترده استفاده میشوند. با این حال، این سیستمها با خطراتی مانند ایمنیزایی، موتاژنز الحاقی و محدودیت در اندازه محموله همراه هستند.
تحویل غیرویروسی
سیستمهای غیرویروسی شامل نانوذرات پلیمری، نانوذرات لیپیدی، ذرات ویروسمانند و وزیکولهای خارجسلولی هستند. این سیستمها ایمنیزایی کمتر و تولید آسانتری دارند، اما عموماً کارایی پایینتر در تحویل ژن و بیان کوتاهمدت را نشان میدهند.


کاربردهای بالینی و مطالعات ژندرمانی AAV
- 387 کارآزمایی مداخلهای AAV در ClinicalTrials.gov ثبت شدهاند.
• پوشش 6 دسته بیماری اصلی: چشمی، عصبی-عضلانی، عصبی، قلبی-عروقی، خونی، اختلالات ذخیرهای لیزوزومی
• مراحل کارآزمایی از فاز I تا III، با ارزیابی چندین سروتیپ (AAV1-AAV9)

مروری بر ویروسهای (AAV)
- ویروسهای وابسته به آدنو به دلیل پروفایل ایمنی مطلوب و توانایی هدفگیری بافتهای متنوع، پرکاربردترین حاملهای ویروسی در ژندرمانی هستند.
- AAVهاویروسهای بدون پوشش و بیستوجهی با قطری حدود ۲۲ تا ۲۶ نانومتر هستند که حاوی یک ژنوم تکرشتهای DNA با طول تقریبی ۴.۷ کیلوباز میباشند. این ژنوم توسط تکرارهای معکوس انتهایی (ITRs) احاطه شده است.
- ITRهابه ساختارهای سنجاقسری (hairpin) تا میشوند که برای تکثیر ژنوم، کپسیداسیون و رهاسازی ژنوم درون سلول میزبان ضروری هستند.
- وجود آنتیبادیهای خنثیکننده پیشموجود در انسان میتواند کارایی ناقل را محدود کرده و تجویز مکرر را با چالش مواجه کند.
مراحل ورود سلولی و تراداکشن
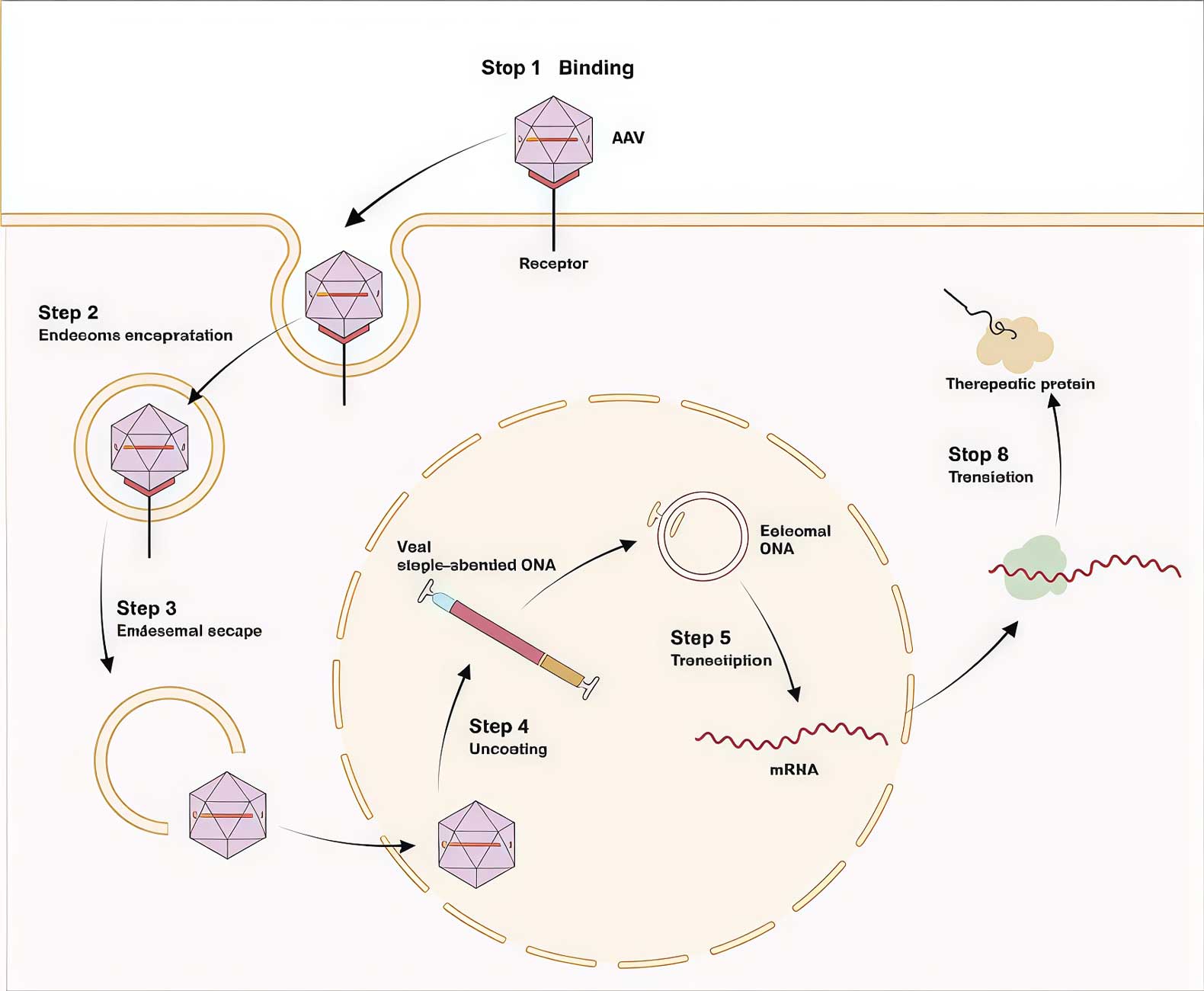
- اتصال به گیرنده:کپسید AAV به گیرندههای اختصاصی سطح سلول متصل میشود (مثلاً HSPG برای AAV2 و اسید سیالیک برای AAV1/5).
- اندوسیتوز: ویروس به درون اندوزومها وارد میشود.
- فرار از اندوزوم و انتقال: کپسید از اندوزوم خارج شده و به سمت هسته سلول حرکت میکند.
- رهاسازی ژنوم و سنتز رشته مکمل: DNA تکرشتهای آزاد شده و به DNA دو رشتهای تبدیل میشود.
- رونویسی و ترجمه: ژن درمانی رونویسی شده و به پروتئین عملکردی ترجمه میشود.
هر یک از این مراحل را میتوان از طریق مهندسی کپسید بهینهسازی کرد تا:تروپیسم (تخصص هدفگیری) بهبود یابد و از شناسایی سیستم ایمنی جلوگیری شود.
تحویل ویروسی در درمانهای ژنی تاییدشده
حاملهای ویروسی اساس درمانهای ژنی درون تنی (in vivo) را تشکیل میدهند.
موارد کاربردی تاییدشده
- لوکسترنا (Luxturna)
- از حامل AAV2 برای انتقال ژن عملکردی RPE65 به سلولهای شبکیه در بیماران مبتلا به آموروز مادرزادی لیبر نوع 2 استفاده میکند.
- نتایج: بازگرداندن عملکرد بینایی در بیماران تحت درمان.
- زولژنزما (Zolgensma)
- با استفاده از کپسید AAV9، ترانسژن SMN1 را به صورت سیستمیک برای درمان آتروفی عضلانی نخاعی (SMA) تحویل میدهد.
- نتایج: بهبود قابل توجه عملکرد حرکتی و افزایش بقا در صورت تجویز زودرس در نوزادان
- درمانهایex vivo با لنتیویروس
در درمانهای CAR-T مانند کیمریاه (Kymriah) و یسکارتا (Yescarta)، از لنتیویروس برای مهندسی سلولهای T بیمار استفاده میشود.
تحویل غیرویروسی در درمانهای تأییدشده
نانوذرات لیپیدی (LNPs) پایه فناوری تحویل در درمانهای RNA تأییدشده بالینی هستند:
1. پاتیسیران (Onpattro)
- siRNA علیه ترانستیرتین را در نانوذرات لیپیدی (LNPs) بستهبندی میکند.
- هدف: جذب توسط هپاتوسیتها در بیماری آمیلوئیدوز ارثی ATTR
- نتایج بالینی: کاهش رسوبات آمیلوئید، بهبود نمرات نوروپاتی
2. واکسنهای کووید-۱۹ Pfizer-BioNTech و Moderna
- mRNA کدکننده پروتئین اسپایک را در LNPs محصور میکند.
- مکانیسم عمل: تحویل سریع و کارآمد به سلولهای عرضهکننده آنتیژن. القای پاسخهای قوی آنتیبادی خنثیکننده.
- تأثیر جهانی: کنترل همهگیری کووید-۱۹
درمان ژنی از یک مفهوم آزمایشگاهی به یک روش تحولآفرین بالینی تبدیل شده است، با چندین درمان تاییدشده که مزایای پایدار در بیماریهای ارثی و اکتسابی را نشان میدهند.
نتیجهگیری
پلتفرمهای تحویل ویروسی و غیرویروسی انتقال هدفمند ژن به اندامهایی از جمله چشم، کبد، عضلات و سیستم عصبی مرکزی را ممکن ساختهاند. هر سیستم تعادلی بین کارایی، ایمنیزایی و ظرفیت حمل بار ایجاد میکند، اما همچنان نیاز به اصلاحات مداوم برای غلبه بر موانعی مانند پاسخهای ایمنی و اندازه محدود وکتور وجود دارد.
فناوریهای ویرایش ژنوم – شامل نوکلئازهای CRISPR-Cas، ویرایشگرهای باز، ویرایشگرهای اولیه و ویرایشگرهای RNAT امکان اصلاح دقیق جهشهای بیماری cا را فراهم کردهاند. این فناوریها با ارائه ویژگی اختصاصی بالا، طیف اختلالات قابل درمان را گسترش دادند، در حالی که نیاز به بهبود تحویل (in vivo) و کنترل اثرات خارج از هدف را برجسته میکنند.
پیشرفتهای آینده با راهنمایی هوش مصنوعی در طراحی وکتورها، حاملهای ترکیبی ویروسی/غیرویروسی مهندسیشده و مواد پاسخگو به محرکها امکان تخصصیابی نوع سلول، دوزهای تکراری و عبور از موانع فیزیولوژیکی را فراهم خواهند کرد. این تحولات زمینه را برای درمانهای ژنی شخصیسازیشده و قابل تکرار در هر دو دسته بیماریهای تکژنی و پیچیده فراهم میکنند.
منابع
-
New approaches in gene therapy for sickle cell disease, moving in vivo
-
Current landscape of mRNA technologies and delivery systems for new modality therapeutics
- Scientists design gene delivery systems for cells in the brain and spinal cord
نویسنده: روان فخرالدین