خلاصه
دنیای شگفتانگیز سلولهای بنیادی روز به روز در حال توسعه و پیشرفت است. کشت سلولهای بنیادی با روشهای درست و محصول بهدستآمده از این کشت، از عوامل اصلی مؤثر در کاربرد و عملکرد این سلولها است. محققان همیشه در حال توسعه وکشف روشهای جدید برای استفاده و بهرهوی از ویژگیهای بیشمار این سلولها هستند. از جدیدترین یافتههای آنها، میتوان به استفاده از وزیکولهای خارج سلولی مشتقشده از سلولهای بنیادی اشاره کرد. این حبابهای کوچک، رازهای پنهان سلولهای بنیادی مادری را کشف میکنند. در این مقاله با تعریف سلولهای بنیادی، انواع آن و روش های مختلف کشت، و سپس با ویژگیهای وزیکولهای خارج سلولی مشتقشده از این سلولها وکاربردهای گوناگون آنها آشنا میشوید.
مقدمه
سلولهای بنیادی(SCs) دستهای از سلولها با ظرفیت منحصر بهفرد برای خود نوسازی و تمایز چند خطی هستند. SCs برای دههها بهعنوان عوامل درمانی مورد استفاده قرار گرفتهاند، اما کاربرد آنها توسط عواملی مانند خطر رد ایمنی و تومورزایی بالقوه محدود شده است. وزیکولهای خارج سلولی (EVs)، یک جزء پاراکرینی کلیدی از قدرت سلولهای بنیادی، بر معایب کاربرد سلولهای بنیادی به عنوان یک عامل درمانی بدون سلول غلبه کرده و نقش مهمی در درمان بیماریهای مختلف ایفا میکنند. با این حال، EVهای مشتقشده از کشت مسطح دو بعدی، SCهایی با بازده پایینی تولید میکند و در مقیاس بزرگ با چالشهایی روبرو هستند که مانع از ترجمه بالینی آنها میشود.
کشت سه بعدی با توجه به توانایی آن در شبیهسازی واقعیتر محیط in vivo، نهتنها میتواند SCها را در مقادیر زیاد تولید کند، بلکه باعث بهبود عملکرد و فعالیت EVs، تغییر محتوای EVs و بهبود اثرات درمانی آنها میشود. وزیکول های خارج سلولی حاصل از کشت سهبعدی سلولهای بنیادی، افقهای جدیدی در پزشکی بازساختی گشودهاند. این ذرات زیستی با غلبه بر محدودیتهای درمانهای سلولی سنتی، امیدهای تازهای برای درمان بیماریهای مختلف ایجاد کردهاند.
انواع سلولهای بنیادی و طبقه بندی آنها
سلولهای بنیادی بر اساس منشأ سازمانی، به سلولهای مغز اسخوان، بند ناف، بافت چربی و جنینی تقسیمبندی میشوند؛ اما بر اساس پتانسیل تمایز، به همه توان، پرتوان، چندتوان، تک توان و الیگو پوتنت تقسیم میشوند. این سلولها در درمان بیماریهای عصبی، قلبی_ عروقی، ژنتیکی و انواع سرطان کاربرد دارند. با این حال، درمان با سلولهای بنیادی محدودیتهایی دارد که شامل خطر تومورزایی میباشد، یعنی سلولهای بنیادی این امکان را دارند که در شرایط خاص به تومور تبدیل شوند. احتمال انتقال عوامل بیماریزا از طریق سلولهای پیوندی وجود دارد، به این صورت که سیستم ایمنی بدن ممکن است سلولهای پیوندی را بهعنوان عامل خارجی شناسایی کند؛ بنابراین، حفظ و انتقال سلولهای بنیادی نیازمند شرایط خاص و پیچیده می باشد. به همین دلیل وزیکولهای خارج سلولی مشتقشده از سلولهای بنیادی که دارای ویژگیهایی مانند ایمنیزایی کم و سمیت کم توجه محققان را جلب کرد.
- بیشتر در مورد وزیکولهای خارج سلولی بدانیم.
این وزیکولها، ذرات دو لایه لیپیدی هستند که انواع مختلفی از جمله اگزوزومها، انکوزومها، میکرووزیکولها، اجسام آپوپتوزیس و سایر زیرگروهها را در بر میگیرند و بر اساس اندازه به دو دسته کوچک و متوسط( بزرگ) طبقهبندی میشوند. این وزیکولها حاوی محتویات زیستی مثل پروتئینها، لیپیدها، اسیدهای نوکلئیک، فاکتورهای رشد و سیتوکینها هستند. وزیکولهای خارج سلولی تقریباً از هر نوع سلولی ممکن است ساخته شوند و از انواع مختلف بافتها، سلولها و مایعات بدن بهدست میآیند.
در مورد عملکرد و مکانیسم اثر آنها میتوان گفت که این وزیکولها دارای عملکردهای مختلفی هستند؛ بهطور مثال با اتصال به گیرندههای خاص، سیگنالهای مولکولی را به سلول منتقل میکنند؛ برخی از آنها همجوشی با غشای سلولی دارند یعنیبهطور مستقیم با غشای سلول هدف ادغام میشوند و محتویات خود را به درون سلول آزاد میکنند و سلولهای هدف میتوانند از طریق فرآیندهای اندوسیتوز و فاگوسیتوز این وزیکولها را جذب کنند، در نتیجه محتویات داخل وزیکولها وارد سلول شده و فرآیندهای مختلف سلولی را تنظیم میکنند.
- از مزایای دیگر این وزیکولها میتوان به موارد زیر اشاره کرد:
- توانیهای مشابه با سلولهای مادری خود را در درمان بیماریها و بازسازی بافت نشان میدهند.
- بهعلت ساختار بدون سلولی که دارند و عدم توانایی تکثیر، خطر ایجاد تومور را کاهش میدهند.
- اندوتوکسین تولید نمیکنند و سمیت سلولی پایینی دارند و ایمنیزایی کمتری دارند.
- از جمله ویژگیهای مهم آنها برای کاربردهای درمانی در آزمایشهای بالینی این است که وزیکولهای تزریقشده در عرض یک ساعت در بافت آسیب دیده قابل شناسایی بودند و تا هفت روز پس از تزریق در بافت باقی ماندند و بهطور خاص بافتهای آسیبدیده را هدف قرار دادند.
- توانایی عبور از سد خونی– مغزی از ویژگیهای بارز این وزیکولها است.
- وزیکولهای خارج سلولی مشتقشده از سلولهای بنیادی مزانشیمی، اختلال سد خونی_ مغزی را در مدلهای سکته مغزی کاهش دادند، این توانایی، EVs را برای درمان بیماریهای سیستم عصبی مرکزی مناسب میکند.
- این وزیکولها همچنین بهعنوان حامل برای مولکولهای درمانی نیز نقش دارند و مولکولهایی مثل siRNA را حمل میکنند و به بافت هدف میرسانند.
- وزیکولهای خارج سلولی را میتوان در دمای-80 درجه سانتیگراد نگهداری کرد. این ذخیرهسازی، با حفاظت فعالیت بیولوژیکی اولیه، تا 6 ممکن است.
مقایسه درمان با وزیکولهای خارج سلولی و سایر روشهای درمانی پیشرفته
- استفاده از وزیکولهای خارج سلولی، در مقایسه با درمان بهوسیله خود سلولهای بنیادی مزیتهایی دارد، از جمله: کاهش خطر تومورزایی و رَد ایمنی، سهولت در ذخیرهسازی و انتقال آنها نسبتبه سلولهای بنیادی، افزایش اثربخشی درمانی و امکان درمان چند هدفی و هدفگیری دقیق.
- وزیکولهای خارج سلولی مشتقشده از کشت سهبعدی سلولهای بنیادی کاربردهای مختلفی دارد مثلاً در ترمیم بافت قلب و بهبود عملکرد عروق، درمان آسیبهای نخاعی و بیماریهای نورودژنراتیو و کاهش فیبروز کبدی و بهبود عملکرد کبد نقش مؤثی را نشان دادهاند و در درمان آسیبهای حاد و مزمن کلیوی مؤثر بودند.
- در مقایسه با سلول درمانی، وزیکولهای خارج سلولی اثر درمانی مشابهی با سلولهای مادری دارند، اما اثر سلول درمانی بالاتر و بیشتر است؛ از طرفی، خطر تشکیل تومور و رد ایمنی با استفاده از این وزیکولها بسیار کم است اما در سلول درمانی این خطر وجود دارد. وزیکولهای خارج سلولی برای درمان بالینی نیز بسیار مناسب هستند اما استفاده از روش سلول درمانی همچنان چالشبرانگیز است.
- این روش بهعنوان یک عامل درمانی بدون سلول، توجه زیادی را به خود جلب میکند. اثرات درمانی وزیکولهای خارج سلولی مشتق از سلولهای بنیادی در بسیاری از آزمایشهای پیشبالینی نشان داده شده است و محققان بالینی بهتدریج از EVها در آزماییشهای مختلف استفاده میکنند. در میان مطالعات ذکر شده در مورد کاربردهای بالینی EV ها، نهتنها ارزیابیهایی از اثرات درمانی آنها وجود دارد، بلکه ارزیابیهایی از ایمنی و تحمل EVها از انواع مختلف سلولها نیز وجود دارد.
محققان با تزریق داخل وریدی، تزریق موضعی به محل آسیب، استنشاق، پانسمان و قطره در بیماریهای کووید 19، سندرم دیسترس تنفسی حاد (ARDS)، روشهای ضد پیری، سوختگی، نارسایی کبدی و سایر بیماریها مداخله کردهاند که نشان میدهد EVها به طرق مختلف در آزمایشهای بالینی به کار میروند و تحقیقات با اشتیاق فراوان در حال انجام است. محققان بالینی شروع به استفاده تدریجی از EVs برای افراد مبتلا به بیماری کردهاند، که نشان میدهد EVها پتانسیل تبدیل شدن به یک عامل درمانی جدید در کاربردهای بالینی در آینده را دارند. EVها به خوبی توسط داوطلبان سالم تحمل شدند و هیچ عارضه جانبی در طول زمان مشاهده رخ نداده است، که نشان میدهد EVs میتوانند اثر درمانی در بیماران داشته باشند و عامل بیخطری برای انسان بهشمار روند.
- چرا وزیکولهای حاصل از کشت سهبعدی کاربردیتر هستند؟
رشد سلولها بر روی لولههای کشت دوبعدی با دیوارههای چسبنده، بر خلاف محیط سهبعدی سلولها در داخل بدن، ممکن است محدود شود، که منجر به تغییر برهمکنشهای سلول_سلول و سلول_ماتریکس خارج سلولی میشود، و ممکن است سلولها را از تقلید کامل عملکردهای بیولوژیکی منع کند و ممکن است ویژگیهای EV های حاصل به خطر بیفتد؛ بنابراین، تعداد فزایندهای از محققان بر روی EVهای مشتقشده از سلولهای بنیادی کشتشده سهبعدی تمرکز میکنند.
تاریخچه کشت سلولی سهبعدی
- اکتشاف کشت سلولی سهبعدی را میتوان در اوایل قرن بیستم ردیابی کرد.
- در سال 1907، ویلسون و همکاران اولین مشاهدات نوترکیبی بیولوژیکی را با نشان دادن اینکه اسفنجهای سیلیسی وقتی در ظرفهای محدود نگهداری میشوند، تحلیل میروند و به تودههای سلولی کوچک تجزیه میشوند، به ثبت رساندند. بعدها مشخص شد که این سلولها توانایی خود سازماندهی و بازسازی را دارند و در نهایت اسفنجهای کاملی را تشکیل میدهند.
- ارمن و همکاران در سال 1956 ردههای سلولی انسانی مختلف را با کلاژن مشتقشده از دم موش با موفقیت کشت دادند که منجر به تشکیل تودههای سلولی بدون استفاده از داربست شد.
- در سال 1978 حاجی کریم و همکاران شکلگیری تودههای کروی ردههای سلولی مختلف تومور را با کشت آنها بر روی سطوح پلاستیکی پوشیدهشده با بستر مایع نشان دادند.
- در اواخر دهه 1980 مونتگومری تأیید کرد که سلولهای رودهای جدا شده میتوانستند ارگانوئیدهای روده مانند را در شرایط آزمایشگاهی از طریق عمل ژل کلاژن تشکیل دهند.
- توسعه کشت سلولی سهبعدی، با جداسازی و کشت موفقیتآمیز سلولهای بنیادی جنینی انسانی مشتقشده از بلاستوسیست ها در سال 1998 پیشرفت بیشتری کرد.
- لونبرگ و همکاران در سال 2003 نشان دادند که کشت داربست پلیمری سهبعدی استاتیک میتواند رشد، تمایز و تشکیل شبکههای عروقی سهبعدی را در سلولهای بنیادی جنینی افزایش دهد.
از کشت بدون داربست گرفته تا استفاده از ژل و داربست و از استاتیک تا دینامیک ،کشت سلولی سهبعدی بهتدریج محیط مساعدتری را برای رشد سلولی فراهم کرده است. با پیشرفت علم بیومواد، ظهور کشت سلولی سهبعدی بر اساس ریزحاملها، داربستهای پرینت سهبعدی، بیوراکتورهای فیبر توخالی و سایر روشها، جهتگیریهای جدیدی را برای توسعه کشت سلولی سهبعدی ارائه کرده است. در واقع کشت سلولی سهبعدی یکی از پیشرفتهترین تکنیکها در زمینه مهندسی بافت و زیست مواد است که به محققان اجازه میدهد محیطهای پیچیدهتر و واقعیتری را برای مطالعه رفتار سلولی ایجاد کنند. این روشها به دو دسته اصلی تقسیم میشوند: فناوریهای بدون داربست و فناوریهای مبتنیبر داربست. هر کدام از این روشها مزایا و چالشهای خاص خود را دارند و انتخاب میان آنها به اهداف تحقیقات و نوع سلولهای مورد مطالعه بستگی دارد. در ادامه به بررسی دقیقتر این تکنولوژیها خواهیم پرداخت.
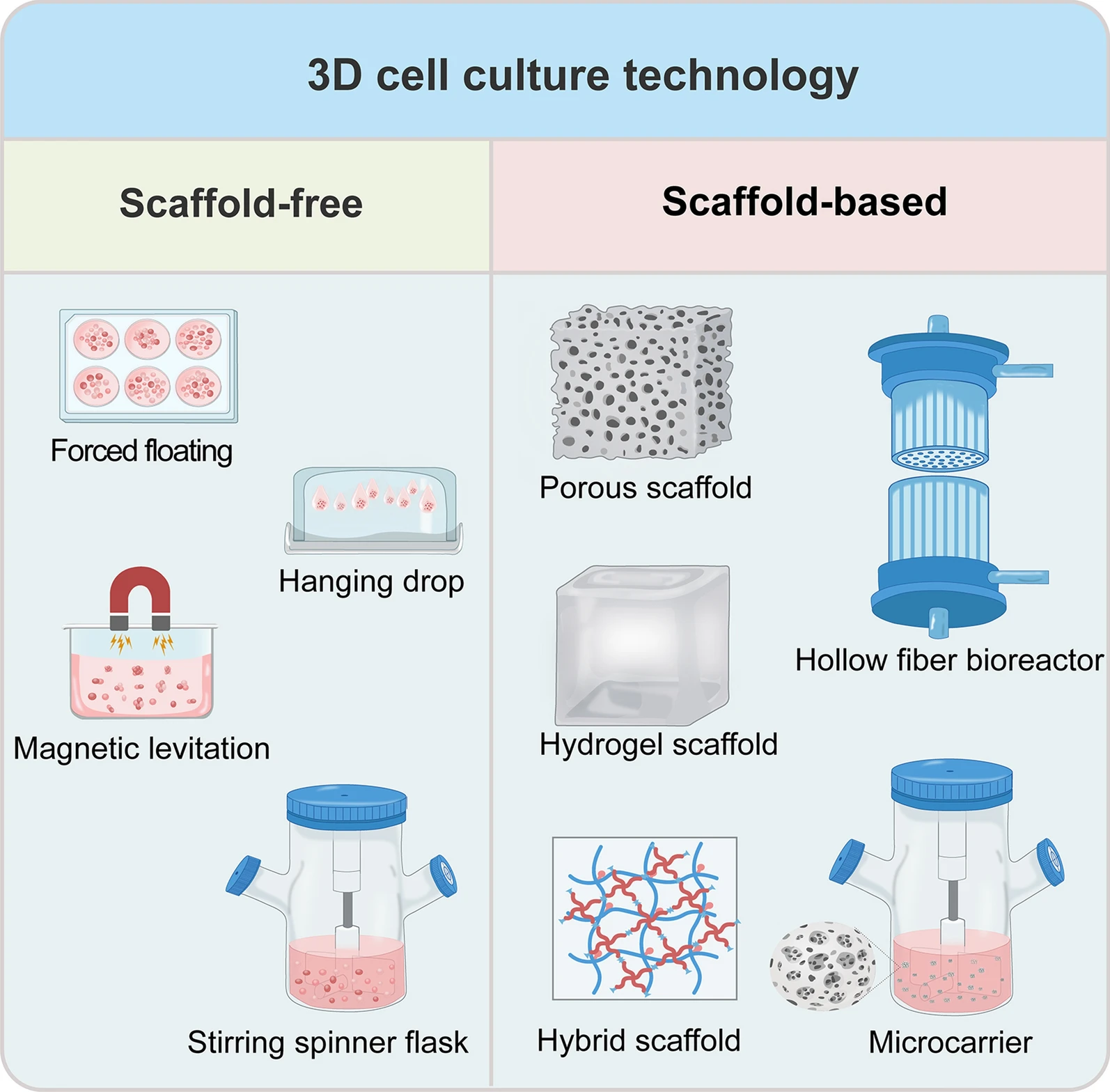
روشهای کشت سلولی سهبعدی
- کشت سلولی سهبعدی بدون داربست جایی است که سلولها در غیاب داربستها برای تشکیل اسفروئید ها به خودی خود جمع میشوند. عمدهترین آنها شامل شناور اجباری، قطره آویزان، شناور مغناطیسی و کشت فلاسک اسپینر همزن است.
- در روش شناور اجباری از صفحات با چسبندگی بسیار کم استفاده میشود، که معمولاً باپوششهای آبدوست یا آبگریز یا آگارز شدهاند. این روش ساده و آسان است اما کنترل دقیق تعداد سلولها در هر اسفروئید دشوار است.
- اما در روش قطره آویزان، سوسپانسیونهای سلولی در قطرات معلق در زیر درب پتری دیش قرار میگیرند. گرانش باعث تجمع سلولها در پایین قطرات و تشکیل اسفروئید میشود. این روش تکرارپذیری خوبی دارد اما تعویض محیط کشت کار پیچیده است.
- در روش شناور مغناطیسی، سلولها با نانوذرات مغناطیسی انکوبه میشوند و سپس در میدان مغناطیسی قرار میگیرند تا اسفروئیدها به سرعت تشکیل شوند. این روش برای انواع مختلف سلولها قابل استفاده است.
- و در آخر، روش کشت فلاسک اسپینر قرار دارد که در این روش، پروانه همزن با حرکت مداوم محیط، تعلیق یکنواخت سلولها را تأمین میکند. این روش برای کشت طولانی مدت اسفروئیدها مناسبتر است؛ زیرا تأمین مواد مغذی و دفع مواد زائد را بهبود میبخشد.
با این حال، همه این روشها یک مسئله مشترک دارند: محیط کشت در حالت راکد است، که میتواند منجر به منابع غذایی نابرابر و دفع نامناسب پسماندها شود، در نتیجه بر کشت طولانیمدت اسفروئیدها تأثیر منفی میگذارد. بنابراین، کشت فلاسک اسپینر پویا مبتنیبر همزن بدون داربست، برای کشت طولانی مدت اسفروئیدها مناسبتر است. در فلاسک اسپینر، پروانه با هم زدن مداوم محیط برای تعلیق یکنواخت سلولها، مواد مغذی کافی را فراهم میکند، در حالیکه چسبندگی سلولها به سطح جامد را کاهش میدهد و تماس سلول به سلول را افزایش میدهد، در نتیجه تشکیل اسفروئیدها را تسهیل میکند.
این روشها بهطور گسترده در مطالعات سرطان، آزمایش دارو و تحقیقات مرتبط با بیماریهای مختلف استفاده میشوند؛ همچنین در زمینه مهندسی بافت برای تولید بافتهای مصنوعی کاربرد دارند. مزایای استفاده از این روشها، شامل شبیهسازی بهتر شرایط فیزیولوژیکی بدن، امکان مطالعه تعاملات سلول_ سلول، تشکیل ساختارهای سهبعدی طبیعی، و قابلیت استفاده برای انواع مختلف سلولها می باشد. و اما چالشهای روشهای کشت بدون داربست شامل دشواری در کنترل دقیق اندازه و شکل اسفروئیدها، محدودیت در تأمین مواد مغذی و اکسیژن به مرکز اسفروئیدها، پیچیدگی در تعویض محیط کشت و انجام آزمایشهای لازم، و نیاز به تجهیزات خاص در برخی روشها میباشد.
- کشت سلولی سهبعدی مبتنیبر داربست از داربستها برای شبیهسازی اجزای ماتریکس خارج سلولی استفاده میکند که پشتیبانی ساختاری و مکانیکی را برای کشت سلولی فراهم میکند و باعث تقویت اتصال و رشد سلولی میشود. این داربستها را میتوان در سه مدل طبقهبندی کرد: داربستهای طبیعی، داربستهای مصنوعی و داربستهای ترکیبی.
- داربستهای طبیعی در کشت سلولی سهبعدی: عمدتاً شامل داربستهایی هستند که از بیومواد طبیعی مانند کلاژن، فیبرین، ژلاتین، آلژینات آگارز و… ساخته شدهاند. کلاژن، پروتئین اصلی ماتریکس خارج سلولی است که زیستسازگاری عالی و خواص مکانیکی مناسبی دارد. این داربست برای کشت انواع سلولها از جمله فیبروبلاستها و سلولهای استخوانی مناسب است. اسید هیالورونیک یک گلیکوز آمینوگلیکان طبیعی با خواص ویسکوالاستیک است که در بافتهای مختلف بدن یافت میشود و برای کشت سلول غضروفی و مهندسی بافت پوست مناسب است. فیبرین یک پروتئین طبیعی درگیر در لخته شدن خون است که برای مهندسی بافت و ترمیم زخم استفاده میشود. از ویژگیهای این پروتئین، قابلیت ژل بستن سریع و حمایت از رشد عروق خونی است. و اما آلژینات، یک پلیساکارید مشتقشده از جلبکهای دریایی است که قابلیت تشکیل هیدروژل را دارد و برای کپسوله کردن سلولها و رهایش کنترل شده دارو استفاده میشود.
- داربستهای مصنوعی در کشت سلولی سهبعدی شامل داربستهایی است که از مواد مصنوعی مثل پلی اتیلین گلیکول، پلی لاکتیککو-گلیکولیک اسید، پلی لاکتیک اسید، پلی کاپرولاکتون و… پلی اتیلین گلیکول پلیمر سنتزی تشکیل شده است و قابلیت تنظیم خواص فیزیکی و شیمیایی را داراست. این داربستها برای ساخت هیدروژلهای زیستسازگار و قابل تجزیه استفاده میشوند و امکان اتصال مولکولهای زیستفعال را فراهم میکنند. اما پلی لاکتیک کوگلیکولیک اسید یک کوپلیمر زیستتخریبپذیر با کاربرد گسترده در مهندسی بافت و سیستم دارورسانی است که خواص مکانیکی و نرخ تخریب آن قابل تنظیم است. پلیکاپرولاکتون یک پلیمر نیمه کریستالی با زیستسازگاری بالا و تخریب آهسته است که برای مهندسی بافت استخوان و غضروف مناسب است و امکان ساخت داربستهای متخلخل با چاپ سهبعدی را فراهم میکند.
داربستهای هیبریدی، ترکیب بهترین ویژگیها!
داربستهای هیبریدی با ترکیب مواد طبیعی مانند کلاژن، و مواد مصنوعی مانند پلیاتیلنگلیکول، ساخته میشوند تا مزایای هر دو روش را داشته باشند. این داربستها استحکام مکانیکی کافی از مواد مصنوعی و زیستفعالی بالا از مواد طبیعی را دارند؛ همچنین قادر به تنظیم ویژگیها نیز هستند، یعنی امکان تنظیم دقیق خواص داربست از جمله تخلخل، سختی و نرخ تخریب برای کاربردهای خاص را دارند که این داربستها در مهندسی بافت، ترمیم زخم و سیستمهای دارورسانی هوشمند استفاده میشوند؛ بهعنوان مثال، طبق تحقیقات، داربستهای هیبریدی ساختهشده از PEG مصنوعی و کلاژن طبیعی دارای استحکام مکانیکی کافی و چسبندگی سلولی بالاتر برای افزایش بیشتر کارایی تمایز چربی SCs مشتق از چربی هستند. داربست آلژینات-PVA که از طریق روش ریختهگری با حلال تولید میشود، میتواند به طور مؤثر و سریع باعث بهبود زخم شود. علاوهبر این، هیدروژلهای طبیعی یا هیدروژلهای مصنوعی کاربردهای مهمی در کشتهای سهبعدی دارند و داربستهای اساسی را میتوان با مولکولهای فعال زیستی اصلاح کرد تا داربستهای بهتری برای کشتهای سهبعدی تولید کنند. بیوراکتور فیبر توخالی و بیوراکتور مبتنیبر میکروحامل نیز بر اساس داربستها توسعه یافتهاند. علاوهبر روشهایی که در بالا توضیح داده شد، مهندسی ورق سلولی، ارگان روی یک تراشه، ارگانوئید، و چاپ زیستی سهبعدی نیز میتواند برای کشت سلولی سهبعدی استفاده شود.
ویژگیهای سلولهای بنیادی کشتشده سهبعدی و وزیکولهای خارج سلولی آنها
آزمایشها نشان میدهد که کشت سهبعدی سلولهای بنیادی، توانایی آنها را برای ترشح EVs افزایش میدهد که منجر به افزایش تولید این وزیکولها میشود. بهعنوان مثال، UCMSCهای (سلولهای بنیادی مزانشیمی استرومایی بند ناف) کشتشده در بیوراکتور فیبر توخالی، 7.5 برابر بیشتر از آنهایی که توسط فلاسکهای کشت دوبعدی تولید میشوند، اگزوزوم تولید میکنند. تولید اگزوزومها توسط hBMMSCs (سلولهای بنیادی مزانشیمی استرومایی مغز استخوان انسان) در کشت سهبعدی با استفاده از روشهای پوششدهی قطرهای و پلی (2-هیدروکسی اتیل متاکریلات) نیز به ترتیب تقریباً دو برابر و 2.4 برابر بیشتر از کشت تکلایه دوبعدی است. افزایش برابری در تولید EVs ممکن است برای روشهای مختلف کشت سهبعدی هنگام کشت سلولهای بنیادی مختلف متفاوت باشد، اما بهطور کلی کشت سهبعدی باعث افزایش ترشح EVs میشود.
کشت سهبعدی میتواند محتویات SC-EVs را تغییر دهد.
کشت hBMMSCها از طریق فناوری چاپ زیستی کواکسیال سهبعدی منجر به تفاوتهای قابل توجهی در محتوای پروتئینی EV های مشتقشده در مقایسه با سلولهای کشتشده با روش دوبعدی سنتی شد. –EVهای 3D تنوع بیشتری از پروتئینها را نشان دادند، با 1023 در مقایسه با 605 در2D-EV، شامل 487 پروتئین منحصربهفرد در 3D-EV و تنها 69 پروتئین منحصربهفرد در 2D-EV. تجزیه و تحلیل KEGG همچنین نشان داد که پروتئینهای منحصربهفرد در-EVs 3Dعمدتاً در “مسیرهای متابولیک”، “ریبوزوم” و “پردازش پروتئین در شبکه آندوپلاسمی” غنی شدهاند، در حالیکه پروتئینهای اختصاصی 2D-EV عمدتاً با فرآیند “آبشارهای مکمل و انعقاد و “هدایت آکسون” مرتبط هستند. علاوهبر این، کشت سهبعدی همچنین منجر به تغییر miRNA در اگزوزومهای مشتق از hESCs (سلولهای بنیادی –جنینی انسانی) شد. تجزیه و تحلیل ریزآرایه نشان داد که 39 مورد در اگزوزومهای 3D در مقایسه باD2 ، تنظیم بالا و 29 مورد کاهش تنظیم یافتند، و محققان با تجزیه و تحلیل 11 miRNA تغییر یافته اولیه miR-6766-3p را شناسایی کردند و نقش آن را در بیماری فیبروز کبدی تأیید کردند. در نتیجه، کشت سهبعدی سلولهای بنیادی تولید و فعالیت EVهای ترشحشده آنها را افزایش میدهد و در عین حال محتویات EVها از جمله پروتئینها و miRNA ها را نیز اصلاح میکند. این ممکن است به تأثیر کشت سهبعدی بر روی شکل سلول، تنش برشی، ماتریکس خارج سلولی و سایر عوامل نسبت داده شود که ویژگیهای سلولها را تغییر میدهند، بنابراین بر ویژگیهای EVs ترشحشده توسط آنها تأثیر میگذارند.
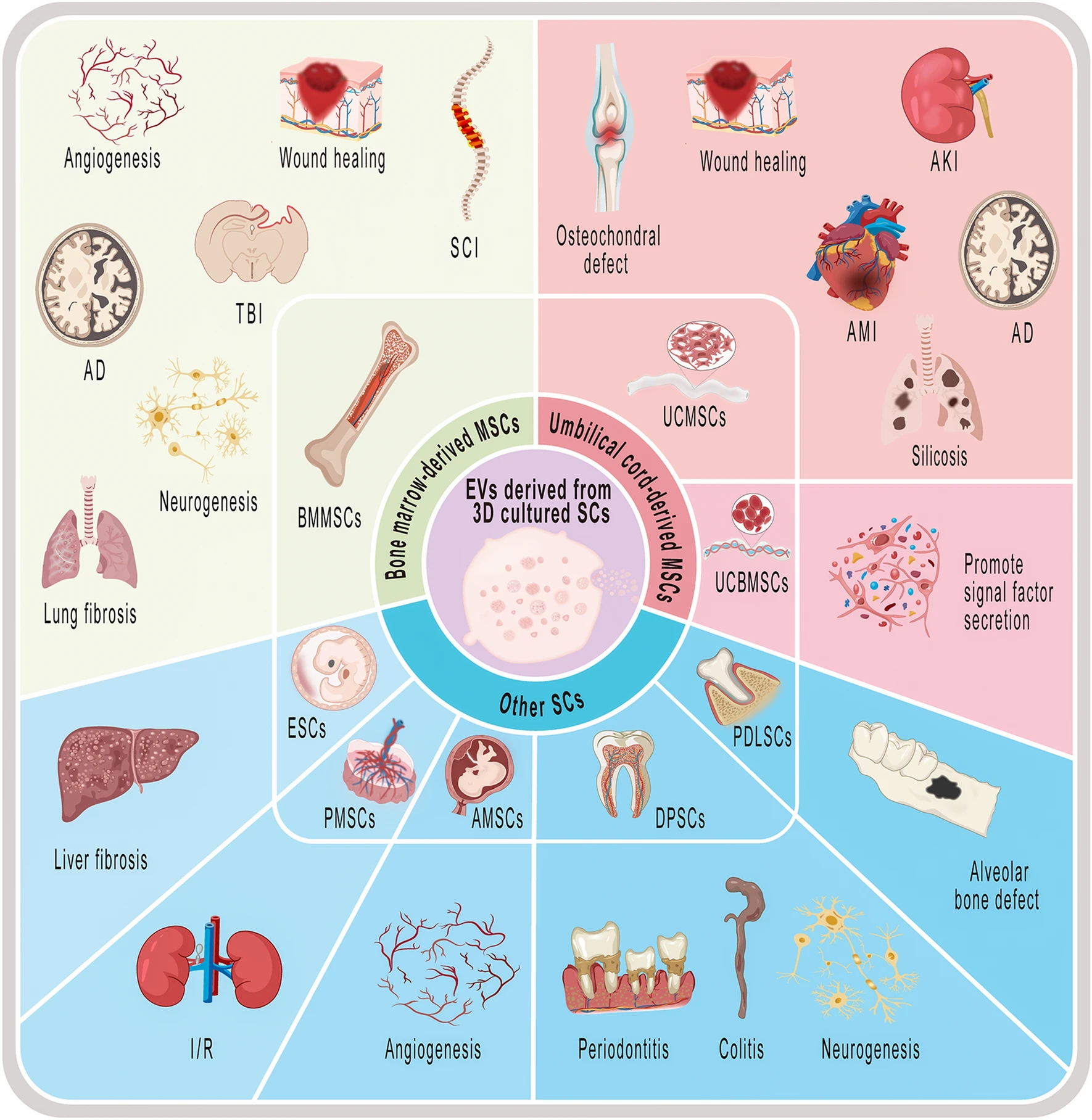
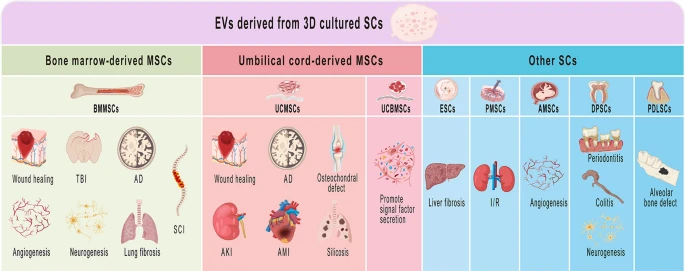
وزیکولهای مشتقشده از سلولهای بنیادی مغز استخوان برای ترمیم زخم، آنژیوژنز(رگزایی)، نوروژنز و فیبروز ریه استفاده میشوند. وزیکولهای مشتقشده از بند ناف برای ترمیم زخمها، نقایص استئوکوندرال، سیلیکوزیس ریه و.. مورد استفاده قرار میگیرند. وزیکولهای مشتقشده از سلولهای بنیادی جنینی برای فیبروز کبد، وزیکولهای مشتقشده از سلولهای بنیادی مایع آمنیوتیک برای آنژیوژنز، وزیکولهای مشتقشده از سلولهای بنیادی لیگامنت پریودونتال برای نقص استخوانی آلوئولی و اگزوزومهای مشتقشده از سلولهای بنیادی پالپ دندان برای پریودنتیت، کولیت و نوروژنز کاربرد دارند
- کاربردهای کنونی EVهای مشتقشده از SCهای کشتشده سهبعدی
- بعضی از کاربردهای EV های مشتقشده از سلولهای بنیادی مزانشیمی- مغز استخوان
EVهای مشتقشده از BMMSCهای کشتشده دوبعدی در ترمیم و بازسازی آسیب، ارتقای تمایز استخوانزایی و فعالیتهای ضد سرطانی مؤثر هستند. با این حال، محققان دریافتهاند که EVهای مشتق شده از BMMSCهای کشتشده سهبعدی در ارتقای بهبود زخم و رگزایی نسبتبه EVs دوبعدی برتری دارند.
- کاربردهای EV های مشتقشده از MSCهای بند ناف
همانند BMMSCها، EVهای مشتقشده از کشت کروی سهبعدی و کشت فلاسک اسپینر سهبعدی UCMSCها در یک مدل ترمیم زخم in vivo، توانستند اپیتلیالیزه شدن زخمها را افزایش دهند و بهبود پوست پس از آسیب را تسریع کنند. علاوهبر این، اگزوزومهای مشتقشده از UCMSCهای کشتشده سهبعدی، اثرات قویتری نسبتبه اگزوزومهای دوبعدی در ترمیم آسیب استئوکندرال، بهبود فعالیت استئوکندرال و بازسازی غضروف نشان دادند.
- کاربردهای EV های مشتقشده از سایر سلولهای بنیادی
محققان علاوهبر کاربردهای EVهای مشتقشده از BMMSCها و UCMSCها، پتانسیل درمانی EVهای مشتقشده از سلولهای بنیادی – جنینی انسانی کشتشده سهبعدی، سلولهای بنیادی مزانشیمی جفت انسانی، سلولهای بنیادی مزانشیمی آمنیون انسانی، سلولهای بنیادی رباط پریودنتال انسانی و سلولهای بنیادی پالپ دندان انسان را بررسی کردند.
نتیجهگیری و دیدگاهها
اگرچه کشت سهبعدی میتواند بازدهی وزیکولهای مشتقشده از سلولهای بنیادی را افزایش دهد و فعالیت آنها را در برخی از جنبهها بهبود بخشد تا اثرات آنها را افزایش دهد. روشهای مختلف کشت سهبعدی منجر به عوامل بیوفیزیکی متفاوتی مانند تنش برشی و ساختار مکانیکی میشود، که تأثیر قابلتوجهی بر روی خواص EVs دارد و منجر به تولید EVs با تفاوتهای زیادی میشود. با این حال، در حال حاضر روشهای مختلف کشت سهبعدی زیادی وجود دارد، و حتی وزیکولهای خارج سلولی تولیدشده با همان روش کشت همچنان نیاز به شناسایی بیشتری دارند. به علاوه، این وزیکولها باید پیش از استفاده در کاربردهای بالینی، تحت کنترل کیفی دقیق قرار گیرند، اما اسناد و مدارکی در مورد مشخصات کیفیت استاندارد صنعتی برای این وزیکولها هنوز وجود ندارد، به این دلیل که کشت سهبعدی از کشت دوبعدی متمایز است و روشهای مختلف کشت سهبعدی منجر به تغییراتی در ویژگیهای EV میشود که تطبیقپذیری کشت سهبعدی را محدود میسازد و مانع کاربرد بالینی آن میشود. علاوهبر این، ارزیابی ایمنی آنها برای کاربرد طولانی مدت in vivo همچنان باید ردیابی و ثبت شود تا مشخص شود که آیا استفاده از آنها ایمن و قابل اعتماد هست یا خیر.
در نهایت ما بر این باوریم که با تلاش مشترک محققان در سراسر جهان، محدودیتهای مربوط به کاربردهای EV گامبهگام برطرف میشود و کاربرد آنها در بیماریهای بالینی امیدوارکنندهتر و ارزشمندتر خواهد بود.
منبع
نویسنده : روان فخرالدین