مقدمه
سلولدرمانی که با نام سایتوتراپی نیز شناخته میشود، یک رویکرد نوین پزشکی است که با انتقال سلولهای زنده و فعال به درون بدن بیمار برای درمان یا پیشگیری از بیماریها شناخته میشود. . با معرفی سلولهای جدید یا اصلاحشده، این روش درمانی هدفمند ترمیم یا جایگزینی بافتهای آسیبدیده را دنبال کرده و فرآیندهای طبیعی ترمیم بدن را تقویت میکند تا نتایج بهتری برای سلامت بیمار به ارمغان آورد. این سلولها ممکن است از خود بیمار (اتولوگ) یا از یک اهداکننده (آلوژنیک) گرفته شوند و طیف متنوعی از انواع سلولها از جمله سلولهای بنیادی، لنفوسیتها و سلولهای دندریتیک را در بر میگیرند که در کاربردهای بالینی مختلفی، از درمان سرطان گرفته تا پزشکی بازساختی، مورد استفاده قرار میگیرند.
مروری بر تاریخچه سلول درمانی
اوایل بنیادین (اواخر قرن نوزدهم)
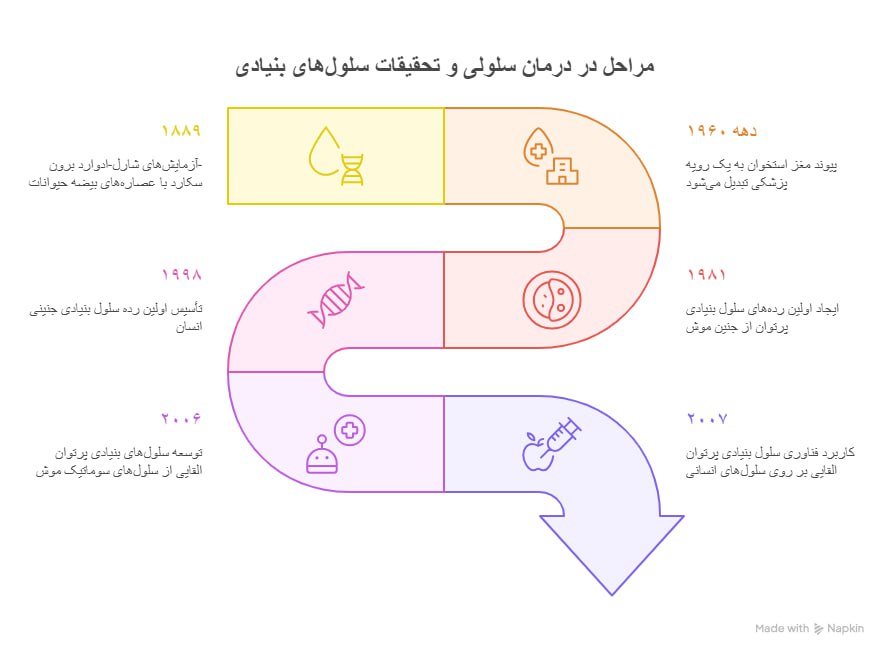
- گسترش به حوزهی درمانهای بالینی و ایمنی
دهههای ۱۹۷۰ تا ۱۹۸۰ – جداسازی لنفوسیتهای نفوذکننده در تومور و درمانهای اولیه بر پایهی سلولهای ایمنی؛ TILهای گسترشیافته با IL‑2 فعالیت ضدتوموری نشان میدهند.
دههی ۱۹۹۰ – پیوند سلولهای بنیادی خون محیطی بهعنوان جایگزینی برای پیوند مغز استخوان ظهورکرده و مدت بهبودی را تسریع میبخشد.
اواخر قرن بیستم تا اکنون – بهکارگیری انواع مختلف درمانهای غیربرپایهی سلولهای بنیادی: فیبروبلاستها، کندروسیتها، سلولهای جزیرهای پانکراس و سلولهای ایمنی مانند سلولهای T اصلاحشده با CAR‑T و TCR.
- ورود به بازارکار و عصر مدرن
۲۰۱۰ – اولین واکسن سرطان مبتنی بر سلولِ خودی (اتولوگ) با تأییدیه FDA به نام پروونژ (PROVENGE®) (برای سرطان پروستات).
از ۲۰۱۷ به بعد – ظهور درمانهای سلولی CAR-T با تأییدیه FDA برای سرطانهای خون مانند کیمریاهKymriah™ و یسکارتا (Yescarta®)
در حال حاضر- رشد مفاهیم درمان چندسلولی (مانند فراکسیون عروقی استرومال و تغلیظشده مغز استخوان) و درمانهای ترکیبی سلولی، بهویژه در پزشکی بازساختی، اختلالات ایمنی و انکولوژی.
انواع سلولدرمانی

۱. درمانهای مبتنیبر سلولهای بنیادی
سلولهای بنیادی، سلولهای تخصصنیافته و خودنوسازی هستند که توانایی تمایز به انواع مختلف سلولها را دارند.
الف. سلولهای بنیادی پرتوانPSCs که شامل موارد زیر است:
– سلولهای بنیادی جنینیESCs : از جنینهای مراحل اولیه بهدست میآیند؛ پرتوان هستند اما تحت مقررات اخلاقی قرار دارند.
– سلولهای بنیادی پرتوان القایی iPSCs) سلولهای بالغ بازبرنامهریزیشدهای که بدون استفاده از جنین، مشابه سلولهای بنیادی جنینی رفتار میکنند.
– سلولهای بنیادی اپیبلاست و سلولهای بنیادی زایا: در مراحل مختلف تکامل یافت میشوند.
کاربردها: پزشکی بازساختی تحقیقاتی (مانند دژنراسیون ماکولا و ترمیم قلب).
نکته کلیدی: پتانسیل تمایز بالا، اما پذیرش بالینی محدود به دلیل موانع اخلاقی و نظارتی.
ب. سلولهای بنیادی بالغ ASCs که شامل موارد زیر است:
– سلولهای بنیادی خونساز (HSCs): سلولهای خونی را تولید میکنند؛ در پیوند مغز استخوان استفاده میشوند.
– سلولهای بنیادی مزانشیمی (MSCs): از مغز استخوان، چربی و جفت بهدست میآیند؛ قادر به تشکیل استخوان، غضروف و چربی هستند.
– سلولهای بنیادی عصبی (NSCs): ترمیم سیستم عصبی.
– سلولهای بنیادی پوست (SSCs): بازسازی پوست.
کاربردها: گسترده — از ارتوپدی تا اختلالات خودایمنی — بهدلیل ویژگیهای بازساختی و تعدیلکنندگی ایمنی.
ج. سلولهای بنیادی سرطانی CSCs:
سلولهای آغازگر تومور که موجب رشد، گسترش و عود سرطان میشوند.
درمانهای هدفمند در صدد مختل کردن مسیرهای بقا و خودنوزایی این سلولها هستند.
۲. درمانهای غیر مبتنیبر سلولهای بنیادی
این درمانها شامل سلولهای سوماتیک تخصصیافته به جای سلولهای بنیادی میشوند.
مثالها: فیبروبلاستها، کندروسیتها، کراتینوسیتها، هپاتوسیتها، سلولهای پانکراس، سلولهای ایمنی (سلولهای T، سلولهای NK، سلولهای دندریتیک).
– درمان سلولی اتولوگ ACT تغییر سلولهای ایمنی برای حمله به سرطان (مانند سلولهای CAR-T، سلولهای T اصلاحشده با TCR، لنفوسیتهای نفوذکننده در تومور).
– جایگزینی/پشتیبانی مانند پیوند سلولهای جزیرهای پانکراس برای دیابت نوع ۱، یا استفاده از هپاتوسیتها برای بیماریهای کبدی.
– ترمیم بافت مانند استفاده از لایههای کراتینوسیتی برای سوختگیها یا ایمپلنتهای کندروسیتی برای غضروف.
۳. درمانهای چندسلولی، شامل فرآوردههای ACT، سازههای مبتنی بر داربست و بدون داربست، SVF و BMAC میشوند.
شامل حداقل دو نوع سلول متمایز هستند که فعالیت بیولوژیکی گستردهتری ارائه میدهند.
دستهها:
– فرآوردههای ACT با جمعیتهای مختلط سلولهای ایمنی (سلولهای T، سلولهای NK).
– فرآوردههای مبتنیبر داربست، سلولهای تعبیهشده در ماتریسهای سهبعدی زیستسازگار.
– فرآوردههای بدون داربست، لایههای سلولی متراکم با ماتریس خارج سلولی خود.
– فراکسیون عروقی-استرومالSVF سلولهای ناهمگن از بافت چربی، شامل سلولهای بنیادی و ایمنی.
– تغلیظشده مغز استخوان BMAC سلولهای مغز استخوان تغلیظشده غنی از سلولهای بنیادی مزانشیمی (MSCs) و فاکتورهای رشد.
– پیوند سلولهای بنیادی مانند مغز استخوان، خون محیطی، خون بند ناف.
۴. درمانهای بدون سلول با اجزای سلولی
مثال: پلاسمای غنی از پلاکت (PRP) – عمدتاً حاوی پلاکتها اما ممکن است شامل برخی لکوسیتها نیز باشد؛ این روش برای ترمیم بافت از طریق فاکتورهای رشد استفاده میشود.
کاربردهای بالینی
۱. پزشکی بازساختی
برای پیوند پوست، ترمیم غضروف و زخمهای دیابتی استفاده میشود.
درمانهای تحقیقاتی شامل PRP، SVF، ADSCs، MSCs و BMAC میشوند.
سلولهای ESCs و iPSCs نشاندهنده پتانسیل بالا هستند اما با موانع اخلاقی و نظارتی روبرو هستند.
مثالهای تأییدشده توسط FDA
– جایگزینهای پوستی ساختهشده از کراتینوسیت/فیبروبلاست برای زخمهای پای دیابتی، سوختگیها و بستر زخمهای دهانی.
– داربستهای کندروسیتی برای نقص غضروف زانو.
– سلولهای بنیادی خونساز (HSCs) مشتقشده از خون بند ناف برای اختلالات خونسازی.
-PRP ضدالتهاب و غنی از فاکتورهای رشد؛ مفید در آسیبهای تاندون/رباط، آرتروز و ترمیم عضلات.
– سلولهای ESCs/iPSCs بهبود بینایی در دژنراسیون ماکولا؛ ترمیم قلبی در مرحله آزمایشی.
– SVF و ADSCs آبرسانی بافتی، نئوواسکولاریزاسیون، کاهش دردهای ارتوپدی و بهبود ایسکمی قلبی.
– سلولهای MSCs نتایج مثبت در سوختگیها، نقصهای استخوانی/غضروفی، کرون و زخم پای دیابتی؛ فواید مرتبط با signaling پاراکرین.
– BMAC بهبود درد و عملکرد ارتوپدی، احتمالاً از طریق فاکتورهای رشد و سلولهای MSCs.

۲. اختلالات سیستم ایمنی هدف: بازتنظیم یا تعدیل سیستم ایمنی برای دستیابی به بهبودی پایدار.
پیوند سلولهای بنیادی خونسازHSCT برای بیماریهای خودایمنی مانند MS، SLE و اسکلروز سیستمیک تثبیت شده است.
سلولهای MSCs و ADSCs فواید تعدیلکنندگی ایمنی نشان میدهند.
پیوند سلولهای جزیرهای پانکراس برای دیابت نوع ۱ مؤثر است.
۳. سرطان
سلولهای CAR-T و واکسنهای مبتنی بر سلولهای دندریتیک DC، از نوآوریهای پیشرو در این حوزه هستند.
فرآوردههای ACT مانند TILها، LAK و سلولهای CIK در انواع مختلف سرطانها نویدبخش بودهاند.
درمانهای ترکیبی (مانند DC-CIK) باعث بهبود بقا و کیفیت زندگی بیماران میشوند.

CAR T-cell
درمان با سلولهای T حاوی گیرنده آنتیژن کایمریک، نوعی ایمنیدرمانی برای برخی انواع سرطان خون است. این روش شامل افزودن یک ژن ساختهشده در آزمایشگاه به سلولهای T بیمار است تا این سلولها بتوانند بهتر سلولهای سرطانی را شناسایی و نابود کنند. گاهی اوقات میتواند سرطان خون را درمان کند؛ در مواقع دیگر به بیماران کمک میکند عمر طولانیتری داشته باشند.
درمانهایی مانند CAR-T نمونهای از همگرایی ژندرمانی و سلولدرمانیاند، جایی که سلولهای ایمنی بیمار بهصورت ژنتیکی اصلاح میشوند تا قدرت هدفگیری سلولهای سرطانی را افزایش دهند. دربارهی اصول ژندرمانی در مقالهی ژندرمانی
توضیح دادهایم.
این روش زمانی به کار میرود که سایر درمانها مؤثر نباشند یا سرطان عود کند، مانند:
- لوسمی لنفوبلاستی حاد سلولهای B (ALL)
- لنفوم منتشر سلولهای B بزرگ
- لنفوم فولیکولار
- لنفوم درجهبالای سلولهای B
- لنفوم مانتل سل
- مولتیپل میلوما
- لنفوم اولیه مدیاستینال سلولهای B بزرگ
چگونه کار میکند؟
لکوفرز – سلولهای سفید خون بیمار جمعآوری میشوند.
تغییر ژنتیکی – آزمایشگاه یک ژن گیرنده آنتیژن کایمریک (CAR) به سلولهای T اضافه میکند.
تکثیر سلولی – سلولهای تغییر یافته تکثیر میشوند.
تزریق – سلولهای CAR T از طریق تزریق داخل وریدی به بیمار بازگردانده میشوند.
سلولها به تکثیر ادامه داده و بهعنوان یک “داروی زنده” علیه سرطان عمل میکنند. که این فرآیند آمادهسازی سلولها ۳ تا ۶ هفته زمان میبرد. و ممکن است نیاز به ترکیب با درمان دیگری (شیمیدرمانی/پرتودرمانی) در طول دوره تولید سلولها باشد.
شیمیدرمانی لنفوکاه قبل از تزریق برای جلوگیری از رد پیوند انجام میشود.
درمانهای تأییدشده توسط FDA
- Kymriah® – برای لوسمی لنفوبلاستی حاد ALL در کودکان و جوانان
- Tecartus® – برای لنفوم مانتل سل
- Yescarta® و Breyanzi® – برای لنفومهای سلول B
- Abecma® و Carvykti® – برای مولتیپل میلوما
مزایای سلولدرمانی
- هدفگیری دقیق – سلولها میتوانند برای شناسایی نشانگرهای خاص بیماری طراحی شوند.
- ماندگاری – برخی درمانها برای ماهها یا سالها به صورت فعال باقی میمانند “داروهای زنده”.
- درمان بیماریهایی که قبلاً غیرقابل درمان بود، امید تازهای در مواردی که داروهای متعارف موفق نبودهاند.
چالشها
- ریسکهای ایمنی – واکنشهای شدید ایمنی (مانند سندرم آزادسازی سیتوکین)، عوارض عصبی و خطر عفونت.
- فرآیند تولید پیچیده – درمانهای شخصیشده اتولوگ به هفتهها کار آزمایشگاهی نیاز دارند.
- هزینه بالا و موانع دسترسی – قیمتها میتواند به صدها هزار دلار به ازای هر بیمار برسد.
- پیچیدگیهای نظارتی – نظارت شدید به دلیل ماهیت زنده و قابل تغییر محصول.
- نیاز به اقامت در بیمارستان برای نظارت وجود دارد.
نتیجهگیری
علیرغم این پیشرفتها، چالشهایی در حوزه درمانهای سلولی و ژنی باقی میماند. مسائلی مانند جمعآوری جمعیتهای سلولی مناسب، تضمین گسترش کافی سلولها و رساندن مؤثر عوامل درمان ژنی به بافتهای مربوطه، همچنان موانعی محسوب میشوند. تحقیقات برای بهینهسازی سیستمهای انتقال ژن و درک بهتر چارچوبهای نظارتی حاکم بر این درمانها ادامه دارد، چرا که محققان اغلب با سردرگمی در مورد دستورالعملهای موجود مواجه هستند. همچنین ارائه درمانهای ترکیبی که شامل ترکیب درمان سلولی با داروها، پادتنها یا روشهای ویرایش ژن برای اثربخشی بیشتر است نیز مورد توجه است.
منابع
- Cell Therapy: Types, Regulation, and Clinical Benefits
- Clinical holds for cell and gene therapy trials: Risks, impact, and lessons learned
نویسنده: روان فخرالدین